Страница: 25/38
Свойство амфотерности лежит в основе буферных свойств белков и их участии в регуляции рН крови. Величина рН крови человека отличается постоянством и находится в пределах 7,36 – 7,4 , несмотря на различные вещества кислого или основного характера, регулярно поступающие с пищей или образующиеся в обменных процессах – следовательно существуют специальные механизмы регуляции кислотно-щелочного равновесия внутренней среды организма. К таким системам относится рассматриваемая в гл. “ Классификация” гемоглобиновая буферная система (стр.28). Изменение рН крови более чем на 0,07 свидетельствует о развитии патологического процесса. Сдвиг рН в кислую сторону называется ацидозом, а в щелочную – алкалозом.
1) Глобулярные белки. Пространственная структура этих белков в грубом приближении может быть представлена в виде шара или не слишком вытянутого эллипсоида - глобулы. Как правило, значительная часть полипептидной цепи таких белков формирует a-спирали и b-складки. Соотношение между ними может быть самым различным. Например, у миоглобина (подробнее о нем на стр.28) имеется 5 a-спиральных сегментов и нет ни одной b-складки. У иммуноглобулинов (подробнее на стр.42), наоборот, основными элементами вторичной структуры являются b-складки, а a-спирали вообще отсутствуют. В вышеприведенной структуре фосфоглицераткиназы и те и другие типы структур представлены примерно одинаково. В некоторых случаях, как это видно на примере фосфоглицераткиназы, отчетливо просматриваются две или более четко разделеннные в пространстве (но тем не менее, конечно, связанные пептидными мостиками) части – домены. Зачастую различные функциональные зоны белка разнесены по разным доменам.
2) Фибриллярные белки. Эти белки имеют вытянутую нитевидную форму, они выполняют в организме структурную функцию. В первичной структуре они имеют повторяющиеся участки и формируют достаточно однотипную для всей полипептидной цепи вторичнкю структуру. Так, белок a-креатин (основной белковый компонент ногтей, волос, кожи) построен из протяженных a-спиралей. Фиброин шелка состоит из периодически повторяющихся фрагментов Gly – Ala – Gly – Ser , образующими b-складки. Существуют менее распростаненные элементы вторичной структуры, пример – полипептидные цепи коллагена, образующие левые спирали с параметрами, резко отличающимися от параметров a-спиралей. В коллагеновых волокнах три спиральные полипептидные цепи скручены в единую правую суперспираль:
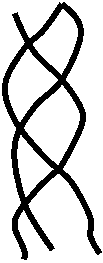 |
![]() Четвертичная структура
Четвертичная структура
В большинстве случаев для функционирования белков необходимо, чтобы несколько полимерных цепей были объединены в единый комплекс. Такой комплекс также рассматривается как белок, состоящий из нескольких субъединиц. Субъединичная структура часто фигурирует в научной литературе как четвертичная структура.
Белки, состоящие из нескольких субъединиц, широко распространены в природе. Классический пример – четвертичная структура гемоглобина (подробнее – стр.26). субъединицы принято обозначать греческими буквами. У гемоглобина имеется по две a и b субъединицы. Наличие нескольких субъединиц важно в функциональном отношении – это увеличивает степень насыщения кислородом. Четвертичную структуру гемоглобина обозначают как a2b2.
Субъединичное строение свойственно многим ферментам, в первую очередь тем, которые выполняют сложные функции. Например, РНК-полимераза из E.coli имеет субъединичную структуру a2bb’s, т.е. построен из четырех разнотипных субъединиц, причем b-субъединица продублирована. Этот белок выполняет сложные и разнообразные функции – инициирует ДНК, связывает субстраты – рибонуклеозидтрифосфаты, а также переносит нуклеотидные остатки на растущую полирибонуклеотидную цепь и некоторые другие функции.
Реферат опубликован: 3/06/2006