Страница: 1/9
Открытие сверхпроводимости было бы невозможным без достижения очень низких температур. Путь к таким температурам начинался с попыток превратить газ в жидкость.
Первые шаги были сделаны в конце XVII века. Английский физик Роберт Бойль в 1662 году и француз Эдм Мариотт в 1676 году независимо друг от друга установили первый газовый закон: при постоянной температуре объем воздуха в закрытом сосуде обратно пропорционален давлению, производимому им на стенки сосуда.
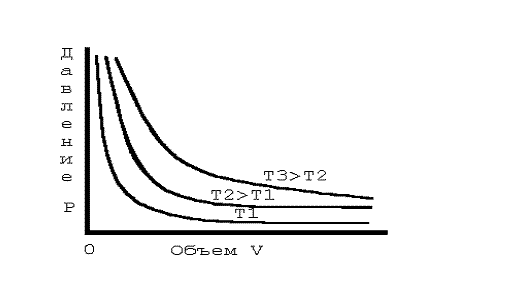
Зависимость одной характеристики состояния вещества от другой при постоянной температуре называется изотермой. Изотермы, найденные Бойлем и Мариоттом, похожи на гиперболы. На графике видно несколько гипербол: каждая из них соответствует своей температуре, причем та гипербола, которая получена при более высокой температуре, располагается выше. Это наблюдение выражается вторым газовым законом, который установил французский ученый Шарль в 1787 году: объем газа при постоянном давлении пропорционален его температуре.
После Шарля расширение газов изучали также и другие ученые, такие как Джон Дальтон, Жозеф Гей-Люссак.
В середине прошлого века французский физик Клапейрон объединил все найденные газовые законы в единый, согласно которому объем V, давление р и температура Т газа связаны простым соотношением pV = RT (R - газовая постоянная, равная примерно 8,3 ДУчебный материал
РОССИЙСКОЙ КОЛЛЕКЦИИ РЕФЕРАТОВ (с) 1996
http://referat.students.ru; http://www.referats.net; http://www.referats.com
ж/К.моль). Этот закон является общим для всех газов.
Двинемся по шкале температур, используя второй газовый закон. Если при снижении температуры на 1оС объем газа уменьшается на 1/273 часть, то примерно при -273оС объем газа должен упасть до нуля, весь газ должен стянуться в точку. Иными словами, должно существовать такое предельное значение температуры, ниже которого само это понятие теряет смысл.
Такое значение температуры английский физик Уильям Томпсон предложил называть абсолютным нулем. Температура Т в законе Клапейрона отсчитывается от этой предельной температуры.
В конце XVII века голландский ученый Маурициус Ван Марум решил выяснить справедлив ли закон Бойля-Мариотта для всех известных к тому времени газов. Среди выбранных им для исследования веществ был аммиак. Ван Марум проводил свои опыты при комнатной температуре, постепенно сжимая газ. Вначале аммиак вел себя так, как предсказывал закон. Но затем произошло неожиданное: при давлении примерно 700 килопаскалей, объем газа резко уменьшился и газ превратился в жидкость.
Физики последовали по пути Ван Марума и смогли сжижить при комнатной температуре еще несколько газов. И все же целый ряд газов, и среди них воздух, кислород, азот и водород, не удавалось превратить в жидкость. Эти газы стали называть "постоянными". Для сжижения постоянных газов требовались не только высокие давления, но и низкие температуры. Одним из первых это понял Майкл Фарадей. В 1823 году Фарадей по поручению английского химика Хамфри Дэви, у которого он тогда работал лаборантом, изучал тепловое разложение химического соединения хлора. Вещество нагревалось в Г-образной герметически запаянной стеклянной трубке. Колено трубки, куда было помещено вещество, нагревалось пламенем спиртовки, второе колено находилось при комнатной температуре. Фарадей обнаружил, что на стенках холодного конца трубки появился какой-то маслянистый желтый налет. После опыта Фарадей долго думал, что это такое и понял, что это мелкие капельки сжиженного хлора. Три года спустя Фарадей вернулся к своему опыту, но теперь дальнее колено он поместил в охлаждающую смесь. Он получил не отдельные капельки, а целы столбик жидкого хлора. Так удалось перевести в жидкое состояние еще несколько газов, но "постоянные" газы устояли и на этот раз.
Реферат опубликован: 20/12/2006