Страница: 2/6
В связи с тем, что при плавлении льда объем, занимаемый водой, уменьшается, давление понижает температуру плавления льда. Эта вытекает из принципа Ле Шателье. Действительно, пусть. лед и жидкая вода находятся в равновесии при О°С. При увеличении давления равновесие, согласно принципу Ле Шателье, сместится в сторону образования той фазы, которая при той же температуре занимает меньший объем. Этой фазой является в данном случае жидкость. Таким образом, возрастание давления при О°С вызывает превращение льда в жидкость, а это и означает, что температура плавления льда снижается.
Молекула воды имеет угловое строение; входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине — ядро атома кислорода, Межъядерные расстояния О—Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно примерно 0,15 нм. Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды
![]()
две электронные пары образуют ковалентные связи О—Н, а остальные четыре электрона представляют собой две неподеленных электронных пары.
Атом кислорода в молекуле воды находится в состоянии ![]() -ãèáðèäèçàöèè. Поэтому валентный угол НОН (104,3°) близок к тетраэдрическому (109,5°). Электроны, образующие связи О—Н, смещены к более электроотрицательному атому кислорода. В результате атомы водорода приобретают эффективные положительные заряды, так что на этих атомах создаются два положительных полюса. Центры отрицательных зарядов неподеленных электронных пар атома кислорода, находящиеся на гибридных
-ãèáðèäèçàöèè. Поэтому валентный угол НОН (104,3°) близок к тетраэдрическому (109,5°). Электроны, образующие связи О—Н, смещены к более электроотрицательному атому кислорода. В результате атомы водорода приобретают эффективные положительные заряды, так что на этих атомах создаются два положительных полюса. Центры отрицательных зарядов неподеленных электронных пар атома кислорода, находящиеся на гибридных ![]() - орбиталях, смещены относительно ядра атома и создают два отрицательных полюса
- орбиталях, смещены относительно ядра атома и создают два отрицательных полюса
|
|
Молекулярная масса парообразной воды равна 18 и отвечает ее простейшей формуле. Однако молекулярная масса жидкой воды, определяемая путем изучения ее растворов в других растворителях оказывается более, высокой. Это свидетельствует о том, что в жидкой воде происходит ассоциация молекул, т. е. соединение их в более сложные агрегаты. Такой вывод подтверждается и аномально высокими значениями температур плавления и кипения воды. Ассоциация молекул воды вызвана образованием между ними водородных связей.
В твердой воде (лед) атом кислорода каждой молекулы участвует в образовании двух водородных связей с соседними молекулами воды согласно схеме,
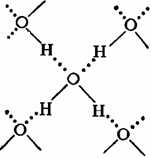
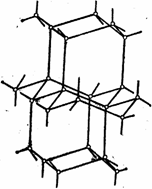
в которой водородные связи показаны пунктиром. Схема объемной структуры льда изображена на рисунке. Образование водородных связей приводит к такому расположению молекул воды, при котором они соприкасаются друг с другом своими разноименными полюсами. Молекулы образуют слои, причем каждая из них связана с тремя молекулами, принадлежащими к тому же слою, и с одной — из соседнего слоя. Структура льда принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры наименее плотным структурам, в ней существуют пустоты, размеры которых несколько превышают размеры молекулы ![]() .
.
При плавлении льда его структура разрушается. Но и в жидкой воде сохраняются водородные связи между молекулами: образуются ассоциаты — как бы обломки структуры льда, — состоящих из большего или меньшего числа молекул воды. Однако в отличит от льда каждый ассоциат существует очень короткое время: постоянно происходит разрушение одних и образование других агрегатов. В пустотах таких «ледяных» агрегатов могут размещаться одиночные молекулы воды; при этом упаковка молекул воды становится более плотной. Именно поэтому при плавлении льда объем, занимаемый водой, уменьшается, а ее плотность возрастает.
Реферат опубликован: 11/05/2007