Страница: 17/24
Постулаты Бора дают возможность вычислить полную энергию атома исходя из уравнений:
mvR=nh/2π (1)
![]() (2)
(2)
![]()
![]() (3)
(3)
V=nh/2πmR; n2h2/4π2mR3=Ze2/R2
R=n2h2/Ze24π2m
E=-![]() (4) где n =1, 2, 3…
(4) где n =1, 2, 3…
Полную энергию атома при определенном стационарном состояии называют энергетическим уровнем. Вычисляя значения E при n=1, E при n=2 и т. д., получаем ряд значений энергии:
Е1=-13,53 эВ; Е2=-3,4 эВ; Е3=-1,5 эВ; Е4=-0,8 эВ и т.п.
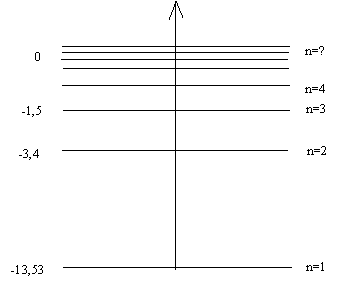
При n=∞ Е∞=0.
После вычислений строим график (рис.5.):
Рис.5.
Ось энергии в этом графике берут вертикальной, за начало отсчета выбирают энергию атома, когда его электрон удален в бесконечность – это нулевой уровень энергии атома. Так как энергия атома орбитальна, то все последующие значения энергии будут ниже нулевого уровня. Минимум энергии (E1=-13,53эВ) атома соответствует невозбужденному его состоянию, когда электрон находится на наиболее близкой к ядру орбите. Выбирают масштаб таким образом, чтобы потом легко было разделить отрезок, соответствующий расстоянию между уровнями E∞ и E1 на 4, 9, 16 и т. д., равных частей. Построенное таким образом изображение значений энергии атома в различных его состояниях называют энергетической моделью атома.
Энергетическая модель атома дает ряд объяснений:
а) объяснение происхождения линейчатых спектров.
Линейчатый спектр испускания объясняют переходом атома, находящегося в возбужденном состоянии, с высшего энергетического уровня на более низкий. Например, при переходе со второго энергетического уровня на первый энергия атома уменьшается на Е2-Е1=1,77 эВ; при этом испускается фотон света с длиной волны, равной
λ=![]()
Линии поглощения в спектре атома образуются в результате перехода атома с энергетического уровня, соответствующего невозбужденному состоянию атома, на более низкий уровень за счет энергии получаемой из вне. Так как атом обладает вполне определенными, дискретными значениями энергии, то и длины волн излучаемого или поглощаемого света вполне определены. Чем больше разность энергий уровня атома, тем меньшей длины волны испускается свет.
б) Объяснение люминесценции.
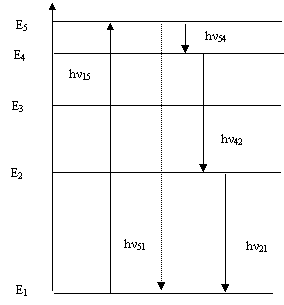 Механизм флюоресценции показан на рис.6.
Механизм флюоресценции показан на рис.6.
Рис.6.
Фотон с энергией hν15 поглощается молекулой, переводя ее из состояния с энергией Е в возбужденное состояние Е1 . Обратный переход может идти прямо (пунктирная линия) или в виде каскадного процесса, когда испускаются различные фотоны с энергиями hν54 , hν42 , hν21 , причем энергия поглощенного фотона (hν0) может оказаться меньше суммарной энергии испускаемых фотонов (hν) . Часть энергии фотона (А) передается соседним молекулам и затрачивается на различные внутримолекулярные процессы. Поэтому справедливо равенство:
hν = hν0 –A
Откуда ν < ν 0, λ > λ0 ,то есть длина волны испускаемого света при люминесценции меньше длины волны падающего света.
Фосфоресценцию наблюдают в кристаллах, где центрами свечения являются атомы, ионы или группы их. Электрон, возбужденный поглощаемым светом, нередко отделяется от центра свечения. При возвращении электрона на прежнее место свечение возобновляется. Так как скорость перемещения электрона в кристалле мала, то свечение может продолжаться длительное время.
Поэтому при изучении энергетических диаграмм полезно сопоставить их с планетарной моделью Резерфорда – Бора, обратив внимание на важные моменты:
1. В энергетической модели орбит нет, указываются лишь энергии атомов в определенных состояниях.
Реферат опубликован: 4/04/2008